Користувацький вхід
Останні публікації
Органічні речовини. Макромолекули: полісахариди, білки, їхня будова, властивості, функції
Зареєструйтесь,
щоб мати можливість переглядати всі сторінки та файли,
публікувати власні матеріали, отримувати сертифікати.
Урок 3
Макромолекули: полісахариди, білки, їхня будова, властивості, функції. Лабораторна робота № 2 «Вивчення властивостей ферментів»
Мета.
Освітня. Сформувати знання учнів про природні полімери; ознайомити із будовою, властивостями і функціями полісахаридів та білків; розкрити значення цих органічних сполук у живій природі.
Розвиваюча. Розвивати уміння порівнювати будову та функції органічних молекул та сполук у клітинах живих організмів; уміння спостерігати, аналізувати та робити відповідні висновки.
Виховна. Виховувати матеріалістичні погляди та уявлення про спадковий зв’язок живої і неживої природи на основі єдності хімічного складу.
Тип уроку. Засвоєння нових знань.
Форма уроку. Синтетична.
Місце уроку в навчальній темі. Поточний.
Методи і методичні прийоми:
1. Інформаційно- рецептивний:
а) словесний: розповідь-пояснення, опис, бесіда, повідомлення учнів, робота з підручником.
б) наочний: ілюстрація, демонстрація;
в) практичний: виконання лабораторної роботи.
Прийоми навчання: виклад інформації, пояснення, активізація уваги та мислення, одержання з тексту та ілюстрацій нових знань.
2. Репродуктивний.
Прийоми навчання: подання матеріалу в готовому вигляді, конкретизація і закріплення вже набутих знань.
3. Проблемно - пошуковий: постановка проблемного питання.
Прийоми навчання: постановка взаємопов’язаних проблемних запитань, активізація уваги та мислення.
4.Релаксопедичний: психологічне розвантаження.
Міжпредметні зв ́язки: хімія, фізика, географія.
Матеріали та обладнання: схеми, малюнки, таблиці.
Основні поняття та терміни: органічні сполуки, полімери, біополімери, мономери, білки, ферменти, амінокислоти, рівні організації білкової молекули.
ХІД УРОКУ
І. Актуалізація опорних знань та чуттєвого досвіду учнів.
1. З’ясувати знання учнів про вуглеводи.
Про які сполуки йде мова?
- малі молекули, що легко розчиняються у воді і солодкі на смак? (моносахариди);
- солодкі на смак, кристалізуються, легко розчиняються? (дисахариди).
2. Пояснити функції вуглеводів:
- енергетична; структурна; опорна; запасна; захисна.
3. За рахунок чого до складу живих організмів входить 2×1018 видів білків?
ІІ. Мотивація навчально-пізнавальної діяльності учнів.
Повідомити тему, мету та завдання уроку.
ІІІ. Сприймання та засвоювання учнями нового матеріалу.
Розповідь про полісахариди.
Олігосахариди – полімерні вуглеводи, в яких 2–10 моносахаридних ланок з’єднані ковалентними (глікозидними) зв’язками. Зокрема, дисахариди утворені сполученням залишків двох молекул моносахаридів.
Приклади дисахаридів: мальтоза (солодовий цукор) – складається з двох залишків глюкози; сахароза (буряковий або тростинний цукор) – складається із залишків глюкози і фруктози; лактоза (молочний цукор) – складається з глюкози та галактози; трегалоза (грибний цукор) – складається з двох залишків глюкози. Вони мають солодкий смак і добре розчиняються у воді.
Полісахариди – це біополімери, молекулярна маса деяких з них може сягати кількох мільйонів. Полісахариди відрізняються один від одного не тільки складом мономерів, а й довжиною та ступенем розгалуженості ланцюгів. Одні полісахариди складаються із залишків одного й того самого моносахариду, інші – різних.
Приклади полісахаридів: крохмаль, целюлоза, глікоген, пектин, лігнін, хітин та ін. Вони майже не розчиняються у воді і не мають солодкого присмаку. Вуглеводи можуть вступати у зв’язок з іншими сполуками. Такі вуглеводи називають складними. Приклади: глікопротеїди (сполуки вуглеводів з білками), гліколіпіди (сполуки вуглеводів з ліпідами).
Функції вуглеводів досить різноманітні (енергетична, резервна, будівельна, транспортна, захисна).
- Енергетична функція. При розщепленні 1 г полісахаридів або
олігосахаридів до моносахаридів виділяється 17,6 кДж теплової енергії. Вуглеводи відіграють провідну роль в енергетичному обміні: вони здатні як до окиснення, так і до розщеплення у безкисневих умовах. Це надзвичайно важливо для організмів, які мешкають в умовах дефіциту кисню (наприклад, паразити внутрішніх органів людини і тварин) або за його повної відсутності (анаероби, як-от дріжджі, деякі види бактерій).
- Резервна функція. Полісахариди можуть відкладатись у клітинах про запас, найчастіше у вигляді зерен. У клітинах рослин накопичується крохмаль, тварин і грибів – глікоген (мал. 8.3). Ці запасні сполуки є резервом поживних речовин.
- Будівельна (структурна) функція вуглеводів полягає в тому, що полісахариди входять до складу певних структур. Так, нітрогеновмісний полісахарид хітин міститься у зовнішньому скелеті членистоногих і клітинній стінці грибів; клітинні стінки рослин утворені з целюлози. До складу надмембранних структур клітин тварин (глікокаліксу) і прокаріотів (клітинної стінки) входять вуглеводи, пов’язані з білками та ліпідами. Ці сполуки забезпечують з’єднання клітин між собою. Особливі сполуки вуглеводів з білками (мукополісахариди) виконують в організмах хребетних тварин і людини функцію мастила, входячи до складу рідини, що змащує суглобові поверхні.
- Захисна функція. Полісахариди пектини здатні зв’язувати деякі токсини та радіонукліди, запобігаючи потраплянню їх у кров. Мукополісахарид гепарин запобігає зсіданню крові, підвищує проникність судин, стійкість організму до нестачі кисню (гіпоксії), впливу вірусів і токсинів, знижує
рівень концентрації цукру у крові.
Розповідь про білки. Серед усіх речовин органічної природи білки займають особливе місце – вони становлять основу структури всіх живих систем і виконують ряд важливих функцій.
Рівні просторової організації білків.
Відомо чотири рівні просторової організації, або конформації, білків: первинний, вторинний, третинний і четвертинний.
Первинну структуру білків визначає певна послідовність амінокислотних залишків, з’єднаних за допомогою пептидних зв’язків. Саме первинна структура і визначає властивості та функції тієї чи іншої білкової молекули. Часто молекула білка у вигляді такого ланцюга не придатна до виконання свого призначення. Для цього вона, наприклад, має повністю або частково закрутитися у спіраль, тобто набути вторинної структури завдяки водневим зв’язкам. Такі зв’язки виникають між атомами Гідрогену NH-групи одного витка спіралі та Оксигену СО-групи іншого витка спіралі. 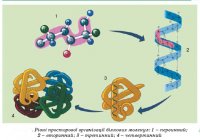 Хоча ці зв’язки значно слабші за пептидні, однак разом вони формують досить міцну структуру. Третинна структура зумовлена здатністю поліпептидної спіралі закручуватися певним чином у грудку, або глобулу, завдяки зв’язкам, які виникають між залишками амінокислоти цистеїну (так звані дисульфідні зв’язки). Підтримання третинної структури забезпечують гідрофобні, електростатичні та інші взаємодії, а також водневі зв’язки. Гідрофобні взаємодії – це сили тяжіння між неполярними молекулами або між неполярними ділянками молекул у водному середовищі. Гідрофобні залишки усяких амінокислот у водному розчині зближуються, наче «злипаються», та стабілізують структуру білка. Електростатичні зв’язки виникають між негативно та позитивно зарядженими радикалами залишками амінокислот. Четвертинна структура білків виникає, коли об’єднуються кілька глобул. Наприклад, молекула гемоглобіну складається з чотирьох залишків молекул білка міоглобіну. Залежно від хімічного складу білки поділяють на прості та складні. Прості, або протеїни, складаються лише з амінокислотних залишків, а складні, або протеїди, у молекулах містять також небілкові компоненти – залишки ортофосфатної та нуклеїнових кислот, вуглеводів, ліпідів, атоми Феруму, Цинку, Купруму тощо. Складні білки називають глікопро теїдами (сполуки з вуглеводами), ліпопротеїдами (з ліпідами), нуклеопротеїдами (з нуклеїновими кислотами) тощо. Багато білків утворюють складні комплекси з пігментами – забарвленими у різні кольори органічними сполуками.
Хоча ці зв’язки значно слабші за пептидні, однак разом вони формують досить міцну структуру. Третинна структура зумовлена здатністю поліпептидної спіралі закручуватися певним чином у грудку, або глобулу, завдяки зв’язкам, які виникають між залишками амінокислоти цистеїну (так звані дисульфідні зв’язки). Підтримання третинної структури забезпечують гідрофобні, електростатичні та інші взаємодії, а також водневі зв’язки. Гідрофобні взаємодії – це сили тяжіння між неполярними молекулами або між неполярними ділянками молекул у водному середовищі. Гідрофобні залишки усяких амінокислот у водному розчині зближуються, наче «злипаються», та стабілізують структуру білка. Електростатичні зв’язки виникають між негативно та позитивно зарядженими радикалами залишками амінокислот. Четвертинна структура білків виникає, коли об’єднуються кілька глобул. Наприклад, молекула гемоглобіну складається з чотирьох залишків молекул білка міоглобіну. Залежно від хімічного складу білки поділяють на прості та складні. Прості, або протеїни, складаються лише з амінокислотних залишків, а складні, або протеїди, у молекулах містять також небілкові компоненти – залишки ортофосфатної та нуклеїнових кислот, вуглеводів, ліпідів, атоми Феруму, Цинку, Купруму тощо. Складні білки називають глікопро теїдами (сполуки з вуглеводами), ліпопротеїдами (з ліпідами), нуклеопротеїдами (з нуклеїновими кислотами) тощо. Багато білків утворюють складні комплекси з пігментами – забарвленими у різні кольори органічними сполуками.
Властивості білків. Функціональні властивості білків зумовлені їхнім амінокислотним складом і просторовою структурою. За формою молекул розрізняють фібрилярні (ниткоподібні) та глобулярні (кулясті) білки. Фібрилярні білки зазвичай нерозчинні у воді й виконують структурну (наприклад, кератин входить до складу волосся людини або шерсті тварин) або рухову (м’язові білки) функції. Натомість глобулярні білки здебільшого водорозчинні та виконують інші функції: наприклад, гемоглобін забезпечує транспорт газів, пепсин – розщеплення білків їжі, імуноглобуліни (антитіла) – захисну. Глобулярні білки менш стійкі (пригадайте з власного досвіду: білок курячих яєць навіть за незначного підвищення температури легко змінює свою структуру).
Одна з основних властивостей білків – їхня здатність під впливом різних чинників (дія концентрованих кислот і лугів, важких металів, високої температури тощо) змінювати свою структуру і властивості. Процес порушення природної структури білків, який супроводжується розгортанням білкової молекули без зміни її первинної структури, називають денатурацією. Здебільшого денатурація необоротна. Але якщо на початкових стадіях денатурації припиняється дія чинників, що призвели до неї, білок може відновити свій початковий стан. Це явище називають
ренатурацією. У живих організмів оборотна денатурація часто пов’язана з виконанням певних функцій білковими молекулами: забезпеченням рухів, передачею до клітини сигналів з навколишнього середовища, прискоренням біохімічних реакцій тощо. Необоротний процес руйнування первинної структури білків називають деструкцією.
ІV. Осмислення об‘єктивних зв’язків та взаємозалежностей у вивченому матеріалі.
Виконання лабораторної роботи “Вивчення властивостей ферментів”.
V. Узагальнення та систематизація знань.

1. Робота з таблицею «Просторова конфігурація білків»
2. Робота з підручником. Знайти відповіді на запитання:
- які хімічні елементи входять до складу білків?
- якого хімічного елемента найбільше у білках?
- яких елементів порівняно небагато у білках?
VІ. Підведення підсумків уроку.
VІІ. Надання та пояснення домашнього завдання.
Предмети: Біологія
Класи: 10 клас
- Увійдіть або зареєструйтесь, щоб залишати коментарі
- 9312 переглядів
Схожі публікації
- Органічні речовини. Малі органічні молекули: амінокислоти, нуклеотиди, їхня будова, властивості, функції
- Органічні речовини. Малі органічні молекули: ліпіди, моносахариди, їхня будова, властивості, функції
- Неорганічні речовини. Елементарний склад живих організмів. 10 клас
- Органічні речовини. Макромолекули: нуклеїнові кислоти, їхня будова, властивості, функції
- Молекулярний рівень організації життя. Єдність хімічного складу організмів
Голосування
Останні коментарі
-
Ваш
-
Ваш
-
Чи можу я отримати або
-
Добрий день! Опублікувала
-
http://metodportal.com/node/s
-
Добрий день. Опубліковала
-
Ваш
-
Вибачте, але це все, що є на
-
Доброго вечора.Вчора
-
Бажаю здоров'я. Чи можу я
-
Ви забули погодитись з
-
Добрий день. Опублікувала
-
Прошу приєднати файл з
-
Всі ваші сертифікати на цій
-
Ваш
Нові теми на форумі
- Гостини-до Лесі на іменини
- Діагностувальна робота. Аудіювання «Цікаве рибеня» Михайло Слабошпицький
- Діагностувальна робота з теми: «Словосполучення. Речення»
- Діагностувальна робота у 3 класі. Перевірка знань умінь і навичок з теми "Дієслово"
- Змінити імя користувача (імя акаунта)
- Презентація до уроку англійської мови "Розрізнення займенників this/that"
Активні теми на форумі
- Правила публікування на Методичному порталі
- Гостини-до Лесі на іменини
- Діагностувальна робота. Аудіювання «Цікаве рибеня» Михайло Слабошпицький
- Діагностувальна робота з теми: «Словосполучення. Речення»
- Діагностувальна робота у 3 класі. Перевірка знань умінь і навичок з теми "Дієслово"
- Змінити імя користувача (імя акаунта)